1.Larutan yang pH-nya tetap atau tidak berubah apabila ditambah sedikit asam, sedikit basa atau pengenceran adalah campuran dari senyawa-senyawa dengan konsentrasi yang sama dari….
A. HNO3 dan KNO3
B. HCOOH + HCOONa
C. CH3COONa + NaOH
D. H2SO4 dan Na2SO4
E. H2SO4 dan NaCl
Kunci Jawaban: B
Pembahasan:
Larutan penyangga adalah larutan yang pH-nya tetap atau tidak berubah apabila ditambah sedikit asam, sedikit basa atau pengenceran. Yang termasuk larutan penyangga adalah campuran antara HCOOH + HCOONa.
2. Perhatikan campuran larutan berikut ini.
(1) NH3 dan NH4Cl
(2) CH3COONa + HCN
(3) HCl + NH4Cl
(4) CH3COOH + CH3COONa
Campuran yang dapat membentuk larutan penyangga adalah….
A. (1) dan (2)
B. (1) dan (3)
C. (1) dan (4)
D. (2) dan (3)
E. (2) dan (4)
Kunci Jawaban: C
Pembahasan:
Dari campuran tersebut, yang dapat membentuk larutan penyangga adalah:
(1) NH3 dan NH4Cl (penyangga basa)
(2) CH3COONa + HCN (bukan penyangga)
(3) HCl + NH4Cl (bukan penyangga)
(4) CH3COOH + CH3COONa (penyangga asam)
3. Hitunglah pH larutan jika 17,1 gram Ba(OH)2 dilarutkan dalam air sehingga volume larutan menjadi 500 mL. (Ar Ba = 137; O = 16; H = 1)
a. 13,60
b. 16,30
c. 8
d. 9,70
e. 11
Pembahasan:

Jawaban: A
4.Sebanyak 0,28 gram kristal KOH ditambahkan ke dalam 50 ml larutan CH3COOH 0,1 M (Ka =10-5). pH larutan yang terjadi jika diketahui Ar K = 39, O = 16, dan H =1 adalah…
a. 3
d. 6
c. 7
d. 9
e. 12
(Jalan Pintas Pintar Kimia, Sumarjono, Andi Yogyakarta, 2009, hal.136)
Jawaban : D
Pembahasan :

1. Jika 100 mL lautan HCl 0,01 M dan 100 mL larutan NaOH 0,1 M dicampurkan, maka jumlah garam NaCl (Mr = 58,5) yang terbentuk adalah…..
a. 58,5 mg
b. 57,5 mg
c. 56,5 mg
d. 55,5 mg
e. 585 mg
Jawaban : E
Pembahasan :
Jumlah mmol NaCl = jumlah mmol HCl
= jumlah mmol NaOH = 10 mmol
Massa NaCl = jumlah mmol NaCl × Mr NaCl
= 10 mmol × 58,5 mg mmol−1 = 585 mg
2. Pada suatu larutan tertentu yang mengandung M ion OH− ,konsentrasi ion H+ larutan tersebut adalah…..

(Nana Sutresna,2007, Cerdas Belajar Kimia untuk Kelas XI : Grafindo, halaman 185)
Jawaban : D
Pembahasan :
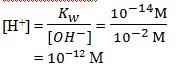
3. Diantara pernyataan berkut, yang benar tentang senyawa organik jika dibandingkan dengan senyawa anorganik adalah…
A. lebih mudah larut dalam air
B. mempunyai titik didih lebih tinggi
C. lebih reaktif
D. lebih stabil terhadap pemanasan
E. lebih mudah terbakar
Pembahasan:
Senyawa organic adalah senyawa yang berasal dari mahluk hidup sedangkan anorganik bukan dari mahluk hidup misalkan bebatuan.
- (a) Senyawa organic sulit larut dalam air karena umumnya bersifat non polar sedangkan air bersifat polar.
- (b) Titik didih lebih rendah karena ikatan yang terbentuk adalah kovalen. Pada anorganik umumnya ionic atau kovalen polar yang mempunyai titik didih lebih tinggi
- (c) Senyawa organic kurang reaktif
- (d) Senyawa organic tidak stabil pada pemanasan tinggi dibandingkan anorganik
- (e) Senyawa anorganik mudah terbakar
Jawaban: E
4. Berikut ini yang bukan merupakan zat yang mengandung senyawa hidrokarbon di dalamnya adalah…..
A. minyak bumi
B. kayu
C. gas LPG
D. daging
E. batuan
Pembahasan:
Hidrokarbon berasal dari mahluk hidup
- (1) minyak bumi berasal dari fosil dan hewan renik yang telah terkubur berjuta juta tahun
- (2) Kayu berasal dari mahluk hidup
- (3) gas LPG adalah fraksi pertama minyak bumi
- (4) daging adalah komponen mahluk hidup
- (5) batuan bukan mahluk hidup
Jawaban : E
5. Pada suhu tertentu 0,350 g BaF2 (Mr = 175) melarut dalam air murni membentuk 1 liter larutan jenuh. Hasil kali kelarutan BaF2 pada suhu itu adalah…
a. 1,7 x 10-2
b. 3,2 x 10-6
c. 3,2 x 10-8
d. 3,2 x 10-9
e. 4,0 x 10-9
(Kimia Untuk SMA Kelas XI, Unggul Sudarmo, Phibeta, 2006, h 219)
Pembahasan:
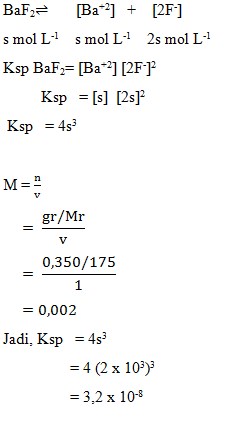
Jawaban : C
6. Larutan Mg(OH)2 jenuh mempunyai pH = 9. Harga Ksp Mg(OH)2pada suhu tersebut adalah…
a. 5 x 10-10
b. 5 x 10-15
c. 1 x 10-15
d. 5 x 10-16
e. 1 x 10-16
(Kimia Untuk SMA Kelas XI, Unggul Sudarmo, Phibeta, 2006, h 219)
Pembahasan:
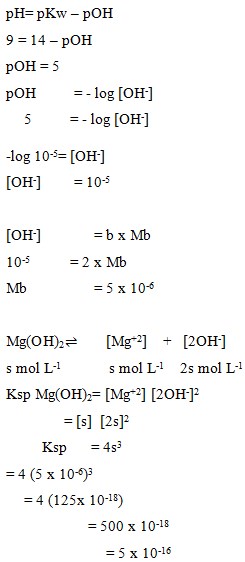
Jawaban : D
7. Fenol dalam karbol atau lisol berfungsi untuk…
a. Menggantikan kaporit
b. Menjernihkan air
c. Mengharumkan kamar mandi
d. Membunuh kuman
e. Mengilapkan lantai
Jawaban : D
Pembahasan
Dalam kehidupan sehari-hari, fenol digunakan untuk membuat karbol, suatu desinfektan untuk kamar mandi dan lantai.
8. Berikut ini yang bukan merupakan sifat benzena adalah…
a. Pada suhu kamar berupa cairan yang mudah menguap
b. Mudah larut dalam air dalam segala perbandingan
c. Merupakan cairan tidak berwarna dan berbau menyengat
d. Dapat larut dalam CCl4 dalam jumlah yang terbatas
e. Merupakan senyawa yang stabil dan sukar bereaksi
(Kimia SMA/MA Kelas XII, Unggul Sudarmo, Erlangga,2015,h 270)
Jawaban : B
Pembahasan
Sifat-sifat benzena :
- Zat cair yang mudah menguap
- Tidak berwarna
- Memiliki bau yang khas
- Titik leleh 5,53oC
- Titik didih 80,1 oC
- Senyawa non polar yang larut dalam pelarut nonpolar (CCl4, eter, aseton, dll)
Jadi, yang bukan merupakan sifat benzena adalah mudah larut dalam air. Karena benzena bersifat nonpolar, maka tidak bisa larut dalam air yang bersifat polar.
9. Oksidasi 1 mol ion sianida (CN–) menjadi ion sianat (CNO–) memerlukan muatan listrik sebanyak ….. Faraday
a. 1
b. 2
c. 3
d. 4
e. 5
Jawaban : B
Pembahasan :
![]()
Dari reaksi diatas terlihat bahwa jika 1 mol ion sianida (CN–) dioksidasi menjadi ion sianat (CNO–) maka akan memerlukan sebanyak 2 mol elektron atau sebanyak 2 Faraday.
10. Reaksi :
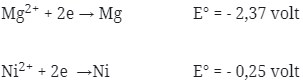
Potensial yang dihasilkan oleh reaksi Mg + NiCl2 → MgCl2 + Ni adalah …
a. -2,12 volt
b. +2,12 volt
c. +1,06 volt
d. -2,62 volt
e. +0,80 volt
Jawaban : B
Pembahasan :
Perhatikan E° nya ! logam yang memiliki E° lebih kecil selalu merupakan anode (mengalami oksidasi). Sudah pasti bahwa Mg adalah anode (mengalami oksidasi) dan Ni adalah Katode (mengalami reduksi).
Pada soal reaksi tidak berbentuk ion, berarti NiCl2 dan MgCl2 dipecah lagi sehingga menghasilkan ion.
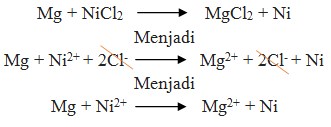
E°sel = E°katode – E°anode
= – 0,25 – (- 2,37 )
= + 2,12 volt
11. Jika pada reaksi N2 + H2 → NH3, kecepatan reaksi berdasarkan N2 dinyatakan sebagai xN dan berdasarkan H2 dinyatakan sebagai xH maka persamaan yang tepat adalah…
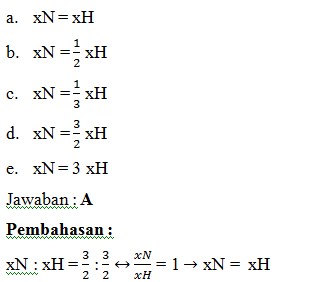
(KIMIA SMA XI. Sri Rahayu Ningsih. Bumi Aksara. 2013, hal: 80)
12. Dalam suatu reaksi kimia, setiap kenaikan suhu 10°C reaksi menjadi dua kali lebih cepat. Beberapa kali lebih cepat reaksi pada 80° C dibandingkan pada suhu 20°
a. 8 kali
b. 16 kali
c. 32 kali
d. 64 kali
e. 128 kali
Jawaban : D
Pembahasan :
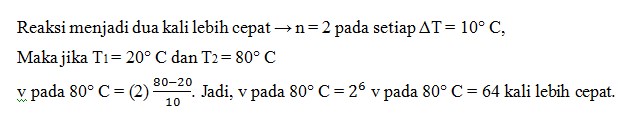

Tidak ada komentar:
Posting Komentar